心房細動とは
2-4 治療
2-4-1 薬物療法
抗凝固療法
心房細動になると心臓内の血流が滞り、血液の塊である血栓ができやすくなります。これが脳動脈に詰まると脳梗塞を発症します。他のタイプの脳梗塞に比較し、重篤になることが多く、壊死する脳の範囲によっては、強い麻痺が残り、場合によっては亡くなります。
そのため、心房細動と診断されたらまず、血液の凝固を防ぐ抗凝固薬の投与が検討されます。検討に当たっては、脳梗塞のリスクをはかる「CHADS2(チャズ)スコア」という指針が用いられます(下表)。
高血圧や糖尿病の有無など、脳梗塞の発症リスクに関わる項目が点数化されており、該当する項目の点数を加算してスコアを求めます。スコアが大きくなるほど、脳梗塞発症リスクは高くなります。そしてスコアが1点以上であれば、抗凝固薬投与を考慮することになります。
ただし、使われる薬剤は、スコア1と、スコア2以上で違いがあります。スコア1には、DOAC(Direct oral anticoagulant)を、スコア2以上には、ワルファリンかDOACを使用します。
| うっ血性心不全 | 1 |
| 高血圧 | 1 |
| 75歳以上 | 1 |
| 糖尿病 | 1 |
| 脳梗塞の既往 | 2 |
それぞれの患者さんが、上記表の5項目の内、どれを持ち合わせているか調べます。それに該当する点数を足して、合計が1〜2点以上なら抗凝固療法を考慮します。
リズムコントロール
リズムコントロールとは、心房細動そのものを起こらないように、または、起きてもすぐに治るようにする治療方法です。これは抗不整脈薬と呼ばれる薬が使われます。
この治療は一般的に、心房細動による動悸症状を自覚する患者さんに対して行われるものです。
心筋が興奮する際には、ナトリウムイオン、カルシウムイオン、カリウムイオンという3つのイオンが、細胞膜に空いている穴(チャンネル)を移動しています。これらのイオンの出し入れがないと心筋は興奮できないのです。
抗不整脈薬とは、これらの3つのイオンのどれかが、もしくは複数が、チャンネルを通りにくくすることで、心筋の興奮を抑制します。
不整脈が起きる時は、心房細動起源が興奮したり、電気が心房の中をグルグルと旋回したりしています。この時、心筋は次から次へと興奮しながら、電気刺激を伝えています。
抗不整脈は、この興奮を抑えることで、心房細動起源の発症や、電気刺激の旋回が起こらないようにしているのです。
心筋の興奮を抑制するので、一般的に抗不整脈薬は心臓の収縮力を弱めます。また、洞結節の機能も低下させてしまい、洞不全症候群を引き起こすことがあります。
すべての薬剤に副作用はつきものですが、抗不整脈薬は催不整脈作用といって、不整脈を止めるために使用したのに、別の更に危険な不整脈(心室頻拍、心室細動)を引き起こすという、他の薬には認められない皮肉な副作用が起こりえます。
この催不整脈作用という、重篤な場合は、死に至るような副作用を認めることより、抗不整脈薬は、自覚症状の強い、発作性心房細動患者さんか、比較的持続期間の短い持続性心房細動患者さんに対して投与されるのが一般的です。
持続期間の長い、持続性心房細動や、1年以上、心房細動が継続しているような慢性心房細動になってしまうと、抗不整脈薬を投与しても、電気ショックでも追加しない限り、薬だけで心房細動が停止することはまずありません。
時折、私達にカテーテルアブレーション目的で紹介されてくる慢性心房患者さんの中に、長期間、抗不整脈薬が投与されたままの患者さんがいます。これは間違った投与方法です。抗不整脈薬はあくまで、洞調律を維持、もしくは戻すことを目的としているので、それがかなわないならば、しばらくして投与を中止しなければなりません。担当医師がおそらく、「不整脈だから抗不整脈薬を投与すべき」と間違った認識をしているためと思われます。
抗不整脈薬のとんぷく療法
心房細動の発作頻度は人により大きく差があります。多い人ではほぼ毎日のように発作が起こりますが、少ない人では1年に1回程度です。この、年1回程度の発作のために、それを予防する薬剤を毎日内服するのは効率的ではありません。また、先ほど述べたように、抗不整脈薬には副作用があります。長期間内服することで、副作用出現の可能性は高くなります。
そこで、こうした発作の頻度が低く、発作の時間も比較的短い人に対しては、継続的な薬の内服ではなく、抗不整脈薬をとんぷくとして用いることがあります。つまり、発作が起こったときだけ、それを抑えるために薬をのむという方法です。ちなみに英語では「pill in the pocket」といいます。直訳すると「丸薬をポケットに」となります。
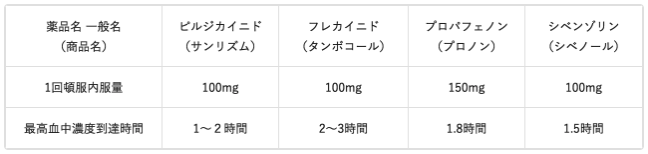
とんぷくにはおもに、下表に挙げた抗不整脈薬を使います。ただしいずれも、継続的な服用の場合より、1回に内服する量が多くなります。発作が起こったとき、それを止めるためには、血中の薬の濃度を一気に、有効濃度(心房細動を止める効果を発揮する濃度)まで上げなければなりません。そのためには、通常の2〜3倍の量を一度に内服する必要があるのです。この方法を用いれば、点滴を受けたのとほぼ同じ程度に、薬物血中濃度が上昇します。
ところが、医師が、もしくは患者さんが、通常の2〜3倍の薬剤量に、漠然と不安を感じ、通常の一回量しか処方、もしくは内服しない場合があります。量を減らしたのでは、とんぷくとして発作を止める効果は期待できません。ときおり、少量でも発作が止まったとおっしゃる患者さんはいますが、その場合はもともと、短時間でおさまる発作だったと考える方が妥当です。
なお、とんぷくで効いているからといって、何年も使い続けていると、やがて効かなくなります。これは薬の耐性が出現したからというよりは、心房細動そのものの病態が進行し、とんぷくでは治まらなくなってきたことによるものが大半です。
レートコントロール
リズムコントロールに対し、心房細動はそのままにして、心房細動による心拍数が速くならないようにする治療が、レートコントロールです。使用されるおもな薬は、「カルシウム拮抗薬」、「β受容体遮断薬」、そして「ジキタリス」です。
レートコントロール治療の目標心拍数
心拍数を適切な数に調整する治療がレートコントロール治療です。ではどのくらいが適切なのでしょうか。
まず認識していただきたいことは、心拍数と脈拍数は一致しないということです。心拍数が速くて不規則だと、心拍によっては心臓が収縮して拍出される血液の量が少なく、脈拍を形成するに至らないものも存在します。この状態を空打ちといいます。心房細動患者さんが自分の脈拍数を数えても心拍数は不明です。心拍数は、聴診器で心臓の拍動を聞くか、心電図を取らないと分かりません。ただし、洞調律の人は、心拍数と脈拍数は一致します。
かつて心房細動患者の目標心拍数とは安静時に90拍/分以下といわれてきました。心臓は体が必要とする血液の量が増したとき、心拍数を上昇させることでそれに応えようとします。しかし、実際には心拍数が90拍/分までは心拍出量は増加しますが、それ以上になると逆に心拍出量は減少します。そのため、コストパフォーマンスを考慮すると、心房細動患者の心拍数は安静時で90拍/分以下とするのがよいと考えられていました。実際つい最近まで、日本循環器学会のガイドラインにもそのように記載されていました。
しかし、この心拍数は臨床試験医基づいて、導き出されたものではありません。そこで約600人の患者さんを安静時の心拍数が80拍/分以下にする厳格調整群と110拍/分以下にする寛大調整群の2群に分けて、3年間の死亡率、症状増悪による入院頻度、脳梗塞発症率などを比較した研究が行われました。結果はそれらのイベント発症率は両群間で有意差は認められなかったのです。寛大調整群は心拍数調整のための薬剤が少なくて済むので、現在では目標心拍数は110拍/分以下で十分と考えられています。
余談ですが、私が研修医の頃には、心不全は心臓の収縮力を高める強心剤による治療が最良で、生命予後を改善させると信じられていました。しかし、その後、それは無効で、逆に心臓の収縮力を弱めるβ受容体遮断薬治療が生命予後を改善させることが明らかとなりました。「昔の常識、今の非常識」です。心房細動患者の目標心拍数も然り。常識を疑い、新たな仮説を立て、それを検証した医師に感謝です。
AFFIRM試験
かつての心房細動治療は、抗不整脈薬や電気ショックを使用し、洞調律に戻す「リズムコントロール治療」が主流でした。しかし2000年頃の研究により、その治療が必ずしも患者さんの生命予後を改善させるわけではないことが分かってきました。
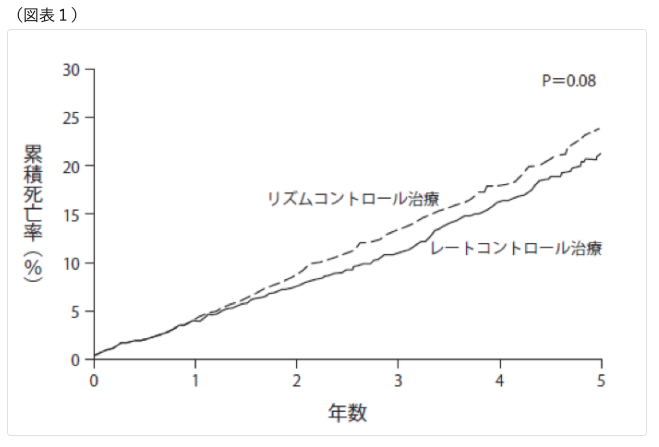
その研究は、循環器医の間ではとても有名な「AFFIRM(アファーム)試験」といいます。4060人の患者さんを2群に分け、一方の群には、抗不整脈薬や電気ショックで洞調律に戻す「リズムコントロール治療」を、もう一方の群には、心房細動はそのままに、安静時の心拍数を80拍/分以下に維持する「レートコントロール治療」を行い、5年間観察し、死亡者数を比較するというのがこの試験の概要です。レートコントロール治療に用いられる薬は、前述したカルシウム拮抗薬、β受容体遮断薬、ジギタリスです。
第1章で心房細動は死亡リスクを2倍に高めると申しました。そうであれば、心房細動を洞調律に戻すリズムコントロール治療を受けた患者さんのほうが、レートコントロール治療を受けた患者さんよりも、死亡率は低くなるはずです。ところが、試験の結果、この2つの治療方法には、死亡率において差がないことが明らかになったのです。(図表1)
この研究結果が報告されて以降、症状の乏しい持続性、慢性心房細動に対しては、無理に洞調律に戻さず、心房細動はそのままで、心拍数だけ速くならないようにするレートコントロール治療で十分という考えが、医師の間で急速に広まりました。
このような結果になった理由の一つは、リズムコントロール治療で洞調律に維持され、死亡率が低下しても、使用された抗不整脈薬の副作用(心機能低下、間質性肺炎、催不整脈作用)によって、その効果が相殺されたことにあるのではないかといわれています。
AFFIRM試験の誤解
このAFFIRM試験の結果が公表されてから、循環器医の間では心房細動を洞調律に戻そうという意欲が急速に冷めてきました。心房細動による症状が強い患者さんにも、「リズムコントロールを行おうが、レートコントロールを行おうが、あなたの死亡率は変わらないから、心房細動のままで我慢しなさい」という説明がまかり通るようになってきたのです。患者さんにとっては、このつらい症状をなんとかしてほしいと思っているのに、とんでもない話です。
AFFIRM試験は、Intention to treat analysisという方法で解析されました。これは、治療を行った結果、洞調律に復したのか、それとも心房細動のままだったのかは完全に無視します。「リズムコントロール」「レートコントロール」のどちらの治療を選択したのかという観点から、死亡率を比較したのです。つまりは、心房細動と洞調律の死亡率を比べたわけではないのです。
Intention to treat analysisの反対が、On treatment analysisという解析方法です。これは、治療の結果、洞調律に復した患者さんと、心房細動のままだった患者さんの死亡率を比べる方法です。これでAFFIRM試験を再度解析すると、どちらの治療方法を選ぼうが、結果的に洞調律に復した患者さんのほうが、心房細動のままだった患者さんよりも、死亡するリスクは半分になったのです。
もう少し細かい解析をすると、抗不整脈薬を内服せずに洞調律を維持できた患者さんの死亡のリスクが最も低く、その次に、抗不整脈薬を使用して洞調律を維持できた患者さんの死亡率が低かったのです。たとえ抗不整脈薬を使用しても、洞調律を維持できれば、心房細動のままの患者さんよりは、死亡率は低かったということです。
まとめると、持続性心房細動、慢性心房細動の場合、死亡率を下げるという観点からは、抗不整脈薬と電気ショックを使用してでも、一度、洞調律に戻す治療を試みるのは、良い治療方法だということです。それで、その治療がうまくいかないなら、同じ方法を繰り返すのではなく、レートコントロール治療にしたほうがよい。また、抗不整脈薬を使用して洞調律がいじされているならば、あえて抗不整脈薬を中止して、元の心房細動に戻すような治療はよくないということです。
2-4-2 カテーテルアブレーション
高周波カテーテルアブレーションの原理
カテーテルアブレーションの原理をご説明します。まずカテーテル先端についている電極を心臓に当てます。次にその電極と脇腹に貼った対局板との間に電気を流します。電極と心臓、対極板と脇腹との間では電気のやりとりがなされるので、そこで熱を発生します。カテーテルについている電極は小さく、電流密度が高いので、高熱となり、それと接触した心筋もやけどをします(動画)。心臓がやけどする範囲は直径5mm、深さ5〜8mmです。対極板が貼られた脇腹でも熱が発生しますが、対極板は大きいため電流密度が低く、温度も低いのでやけどはしません。
心房細動アブレーションの方法
心房細動のメカニズムのところで述べたように、心房細動は、心房細動起源や、心房細動基質ができてしまうことで起こります。カテーテルアブレーションとは、この心房細動起源や心房細動基質を探し出し、そこにカテーテルの先端を押し付けて、電気を流し、その心筋を焼灼する治療です。
完璧な設計図 3次元ナビゲーションシステム
立体的な構造物の心臓の中の状態をどの様に把握して、アブレーションカテーテルを操作し、心筋を焼灼しているのか。以前ならば、レントゲンと手の感覚がすべてでした。私がカテーテルアブレーションを始めた頃は、それしか頼るものがなかったのです。
しかし、最新の機器を使用すると、心臓の中の様子は極めて明瞭に把握できます。それが3次元ナビゲーションシステムというもので、CARTO(カルト)とよばれます。米国のジョンソン・エンド・ジョンソン社が開発しました。
原理はカーナビゲーションシステムと同じです。心臓の周りに磁場を作成し、カテーテル先端に植えこまれたセンサーの位置を把握します。
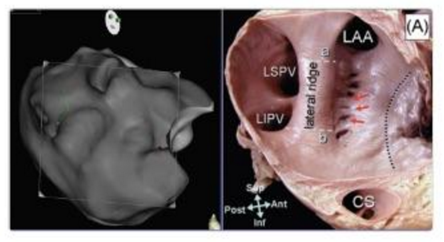
カテーテルアブレーション時には、まずペンタレイという5本のスパインが伸びたカテーテルで、心臓の内面全体をなぞります。カルトは1秒間に60回という高速で、カテーテル先端の位置と電気情報を取得します。心臓全体にカテーテルが行き届けば、心臓の内面が1〜2mmの誤差の範囲内で描き出されます(下図)。
アブレーションする時には、その描き出された心臓の絵を元に、アブレーションカテーテルを必要な場所に持って行き、焼灼するという手順です。
心房細動起源の見つけ方
心房細動起源を見つけるためには、手術中に心房細動が起きてくれなくてはいけません。そのために最良の方法が「高用量イソプロテレノール負荷」です。イソプロテレノールとは、交感神経を刺激して、脈拍が速くなり、心臓の収縮力が高まる注射です。通常の使用量は1μg/分ですが、その20倍の量を投与すると、心房細動患者さんの90%で心房細動が誘発されます。
この方法は、狭心症や閉塞性肥大型心筋症の患者さんには禁忌です。しかし、ほとんどの患者さんで、安全に施行可能です。この方法を使用することにより、心房細動起源の場所が明らかとなります。
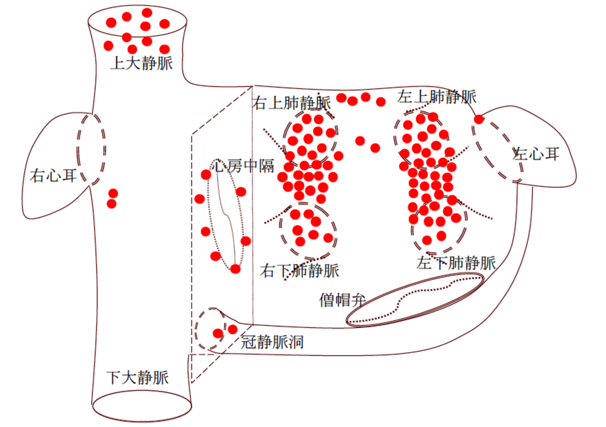
発作性心房細動患者70人にこの「高用量イソプロテレノール負荷」を実施し、心房細動起源の場所を1人ずつ探してみました。結果、心房細動起源の多くは、肺静脈(肺で酸素を取り込んだ血液が心房に戻る時に通る血管)に存在することが判明しました。また、すべての心房細動細動起源を100とすると、肺静脈起源は85%程度で、15%はそれ以外のところに存在することも明らかとなりました。
また、心房細動起源は、1人の患者さんに1か所とは限りません。複数有している人も多くいます。これまでの研究をまとめると、発作性心房細動患者さんの4人に1人は、肺静脈以外にも心房細動起源を有していることが分かっています。
肺静脈隔離術
85%の心房細動起源が肺静脈に存在するので、心房細動カテーテルアブレーションにおける主な焼灼部位は、肺静脈になります。
以前は、肺静脈内の心房細動起源を1つずつ、焼灼していました。しかし、肺静脈の奥で焼灼すると、肺静脈が狭窄を来したり、また、焼灼により、心房細動が術中には治まっても、術後にすぐ再発したりと、諸問題が多く、手術の成功率も余り高く無かったのです。
そこで、肺静脈の付け根を、円周状に焼灼し、電気的に隔離する方法(肺静脈隔離法)が考案されました。当初は、4本ある肺静脈を、1本ずつ隔離する、個別肺静脈隔離法という方法が行われていましたが、、その後、左右2本の肺静脈を同時に隔離する広範囲肺静脈隔離法が、土浦協同病院の高橋淳先生(現横須賀共済病院)と家坂義人先生によって考案され、世界的な標準的治療方法となっています。
上大静脈隔離術
さて、この15%の肺静脈以外の心房細動起源をどの様に治療するのか。15%のうち7〜8%は上大静脈(上腕や頭部の静脈が心臓に戻ってくる時に通る血管)に存在する心房細動起源です。ここから出て来る心房細動は、肺静脈と同様、上大静脈を隔離することで治療可能です。上大静脈と右心房との電気的接合部位を焼灼することにより、上大静脈を隔離し、そこから出てくる心房細動起源を上大静脈内に閉じ込めて、心房細動を起こさないようにします。
上大静脈隔離の際に大きな問題になるのは、横隔膜麻痺です。横隔膜神経は、上大静脈の真横を上下に走行し、横隔膜(胸部と腹部をさかいする筋肉。この筋肉が上下することにより、胸郭が広がったり、しぼんだりしている)の動きを司っています。上大静脈を隔離する際に、この横隔膜神経を熱でやけどさせると、横隔膜の動きが低下、もしくは完全に麻痺します。しかし、横隔膜神経の近くを焼灼する際に、カテーテルの先端を前方、もしくは後方に向けることで、この合併症を起こさずに済むようになります。ちょっとしたコツですが、合併症予防にとても重要な技術です。
非肺静脈由来心房細動起源の治療方法
では、肺静脈、上大静脈以外の心房細動起源はどの様に治療するのか。これはもう、各個撃破しかありません。心房細動起源をポイントで探し当て、そこにカテーテルの先端を押し当てて焼灼します。心房細動カテーテルアブレーションの中で、知識、経験、技術が最も必要な治療で、長い経験を積んだベテラン医師でないと治療は困難です。
心臓内に留置するカテーテルの先端には電極がついており、そこから得られる心電図が外部のモニターに映し出されます。心電図データは、60本以上あります。その中で、心房細動が起きる瞬間に、最も早く興奮する電気信号をとらえるのです。
心臓の中の電気情報を集めるカテーテルは3?4本しか留置していません。すべての心筋の電気情報を観察できるわけではないので、記録された心電図の中で、最も早く興奮する電気信号をとらえても、すぐに起源が見つかるわけではありません。
そこで、ひとつひとつの心電図を見ながら、電気の流れを想像し、心房細動起源がありそうな場所を予測し、そこへカテーテルを移動させます。そして、発症している房細動に対して電気ショックをかけます。前に説明したイソプロテレノールが効いた状態だと、洞調律に復したあともすぐに心房細動が発症します。また、その瞬間に上記と同じ操作を行い、徐々に心房細動起源の場所を絞り込み、特定するのです。そのプロセスは、詰将棋に似ているといってもいいかも知れません。
心臓の解剖や、電気の流れ、マッピングカテーテルの位置などは、患者さんによって全く異なるので、心房細動起源を特定するための方法は、標準化、マニュアル化できません。個々の患者さんごとに、術者が先輩に教えてもらったり、自ら学んだりして習得していくしかないのです。ここが、術者の腕のみせどころであり、治療成績を大きく左右するといっていいでしょう。
肺静脈隔離しか行わなければ、60〜70%の患者さんしか、心房細動は治癒しません。さらに多くの患者さんの心房細動を根治させるには、この非肺静脈由来の心房細動起源を焼灼するしかないのです。
発作性心房細動の成績 薬物治療との比較
個々の患者さんにおいて、カテーテルアブレーションで発作性心房細動が治るか治らないかは、いくつかの因子に左右されます。それは1)心房細動がイソプロテレノールによって誘発されるか否か、2)誘発された心房細動起源を同定できるか否か、3)心房細動起源の数は一つか複数か、4)心房細動起源は心筋の浅いところにあるか、深いところにあるかなどです。これらの因子は患者さんごとに異なり、アブレーション前には予測不可能です。そのため、どの程度心房細動が治るかは、実際にアブレーションしてみないと分からないのです。しかし、100人の発作性心房細動患者さんに、同じような方法で治療を行ったら、100人中何人治ったという統計学的治療成績は算出可能です。以下に、その成績を述べます。
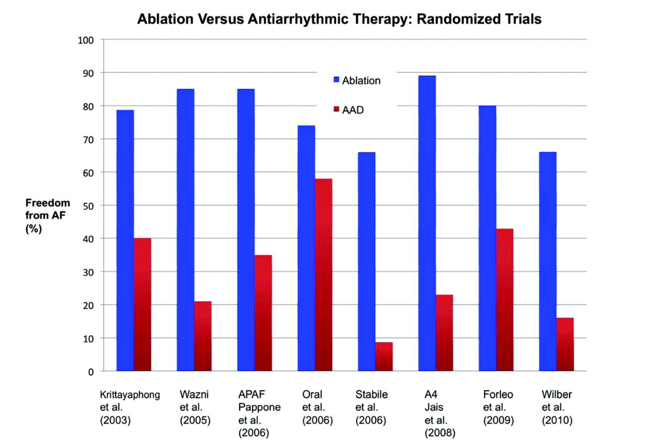
まず、カテーテルアブレーションと薬物の治療成績を比較したものを紹介します。現在までに、その大規模臨床試験は世界に8つ存在します(下グラフ)。ここでは、アブレーションを実施、もしくは薬剤を投与し、その後1年間、30秒以上の心房細動が出現しないことを成功と定義しています。各試験により結果は様々ですが、これらの結果の平均値をとると、発作性心房細動はカテーテルアブレーションにより80%の患者さんで治癒しており、薬剤では30%に留まっています。
発作性心房細動の長期成績
前記の成績は治療後1年間のみをみた結果ですが、それでは長期になるとどうでしょうか。
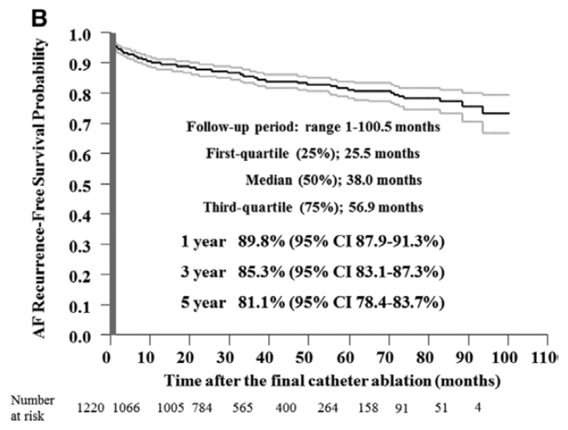
横須賀共済病院で、カテーテルアブレーションを行った発作性心房細動患者さん1220人の、その後5年間の再発率を調査しました。1年後に洞調律を維持している患者さんは72%でした。しかし3年後には65%、5年後には59%程度と、年数の経過とともに徐々に減っていきます。
一方、アブレーション後に心房細動が再発した患者さんには再度アブレーションを実施しています。アブレーションを2回以上受けた後では、1年後で約90%、5年後でも約80%の人で洞調律が維持できています。
まとめると、発作性心房細動に対するカテーテルアブレーションの治療成功率は、1回の治療で1年後に70%、5年後に60%です。再発した患者さんは再度アブレーションを受けていただくことにより、最終アブレーションの1年後に90%、5年後に80%の人が、再発なく過ごせているということです。
持続性心房細動の成績
先にも述べましたが、持続性、慢性心房細動のメカニズムは2つ有ります。心房細動起源と心房細動基質です。
心房細動起源は、高用量イソプロテレノール負荷で探索し、焼灼することが可能です。しかし、心房細動基質に対する治療方法は、今のところ確立したものがありません。
持続性、慢性心房細動に対しても、発作性心房細動同様、心房細動起源を一つ一つ探して焼灼する治療を行うと、持続期間が1年未満の持続性心房細動に対するアブレーションの治療成績は、1回の治療で1年後に洞調律が維持されていたのは80%、3年後では60%でした。再発した患者さんには再度アブレーションを行うことにより、洞調律が維持されるのは、最終アブレーションから1年後で90%、3年後で80%です。
ただし慢性心房細動の場合では、治療成績は悪くなります。持続期間が1〜30年(多くは10年以内)の慢性心房細動の場合、洞調律が維持されていた人は、1回の治療で1年後に60%、3年後では50%を切ってしまいます。しかし、それでも複数回治療を行うと、それぞれ80%、70%まで上昇します。
心房細動アブレーションの合併症とその対策
心房細動カテーテルアブレーションに起因する重大合併症は3つあります。それは脳梗塞、心タンポナーデ、そして食道関連合併症です。世界レベルの調査によると、結果として死に至る重篤な合併症は0.1%、1000人に1人の割合で発症しています。
この治療方法を、安心して患者さんに受けてもらい、世の中に普及させるには、安全性の担保が必要であると確信しています。そのため、今まで、この合併症をゼロに近づけるために、ありとあらゆる工夫と努力をしてきました。
ここでは、カテーテルアブレーションにより起こりうる合併症とその対策についてご説明します。
脳梗塞
0.1%の頻度で、脳梗塞を合併します。アブレーション中は、体にとって異物であるカテーテルを、ある一定時間体内に留置せざるをえません。カテーテルには血栓がつきにくくなるような処置が施されていますが、それでも、付着することがあります。また、先に述べたように、高周波通電中に高温に達したアブレーションカテーテルの先端に、血液が凝固することもあります。
これらの術中に発症する血栓に対して、予防対策がとられています。
ワルファリンやDOACなどの抗凝固薬を継続したままアブレーションを実施することです。以前は、術中の出血性合併症の発症を危惧して、アブレーション前に抗凝固薬を中止していました。しかし、そのことにより、アブレーション中に、カテーテルに血栓が付着することがあったのです。
また、術直後も同じです。アブレーション直後には、電気ショックなどにより、心臓の動きが悪い状態が起こりえます。その間は、血栓が出来やすい。しかし、ワルファリンやDOACの抗凝固薬が、効いていれば、血栓予防につながるというわけです。
では、抗凝固薬が効いた状態で、出血性の合併症を引き起こしたらどうなるのか。薬が効いた状態では、中々、血が止まりません。
しかし、ワルファリンには中和剤があります。それを投与すると、ワルファリンの効果はたちどころになくなります。また、この中和薬は、DOACのリバーロキサバン、アピキサバン、エドキサバンにも有効です。
ガイドライン上は、CHADSスコアが0の心房細動患者さんは、抗凝固薬を内服する必要がありません。しかし、そのような患者さんでも、心房細動アブレーションを実施する際には、手術に起因する脳梗塞を予防するために、術前に抗凝固薬を内服した方が良いのです。
心タンポナーデ
心タンポナーデとは、心臓に小さい穴があき血液が漏れ出てしまい、心臓の周囲に溜まり、心臓を圧迫してしまう合併症です。発生頻度は1%程度で、多くは、心臓の周囲に漏れた血液を抜き取ることで、出血は自然停止します。しかし、稀に、出血が止まらず、外科的に開いた穴を縫い合わせる手術が必要になることもあります。更に稀ですが、開いた穴が大きかったり、発症に気づくのが遅れたりすると、重篤な状態になり、死に至ることもあります。
心タンポナーデが起こってしまう要因は、大きく3つあります。1)心房中隔穿刺時に、中隔以外の心臓に針を刺し、穴が開いてしまう、2)カテーテル操作時に心筋を押しすぎて心筋が裂けてしまう、3)心筋を焼きすぎて穴があいてしまうことです。
しかし、上記の3つの要因も、技術開発により、ほぼ起こさずに済むようになりました。
心房中隔穿刺は心腔内エコーと高周波穿刺針を用いることで、他の心筋を誤穿刺することはありません。
また、コンタクトフォースアブレーションカテーテルにより、カテーテルが心臓を押す力を数値化でき、押しすぎると、警告が出るように設定できます。
なお、多少専門的ですが、焼灼中の通電回路内のインピーダンスを測定することで、過度な焼灼が行われていないかも推測可能です。
テクノロジーの発展は、治療効果のみならず、安全性の向上にも寄与しています。しかし、このような最新のテクノロジーを使用しても、最終的にカテーテルを操作するのは、人間です。慎重な操作を心がけるのが重要です。
食道関連合併症
心臓の治療なのに、なぜ食道に合併症?と不思議に思われる人もいるかも知れません。実は食道は心臓のすぐ後ろに位置しており、アブレーションによる熱が伝わりやすいのです。軽度の食道炎を含めれば、心房細動アブレーションを実施した10〜20%の患者さんに食道障害を来します。
極めて稀ですが、大きい食道潰瘍が形成され、心臓との間に瘻(連絡路)ができてしまい、心房食道瘻という合併症を起こすことがあります。激しい胸の痛み、高熱、脳梗塞症状を呈します。これらの症状は、アブレーション後数週間で発症するので、患者さんも医師も、その症状がアブレーションに起因するものだと、思いつかず、診断が遅れる原因となります。心房細動アブレーションに伴う重症合併症の一つで、重篤化すると死亡する危険性が高いので、早期発見が重要です。そのような症状があれば、すぐに担当医に相談してください。医師は、この合併症を疑えば、胸部CTを実施します。診断されれば、多くの場合は、外科的治療が必要です。
また、胃蠕動(ぜんどう)障害という合併症もあります。食道の壁を走行している迷走神経を熱でやけどさせることで発症します。迷走神経は、胃などの消化管の動きを調整しており、その障害により、食事をすると、すぐにおなかが張ったような感じを自覚します。根本的な治療方法はなく、基本的には経過を見るしかありません。多くは数ヶ月から半年で症状は改善します。
これらの食道関連合併症を予防するために、大切なことは、アブレーションの際に、食道近くの心房を焼灼しないということです。そのため、手術時には、造影剤を飲んで頂き、食道の走行を確認します。
どうしても食道上の心房を焼灼しなければならない時は、食道の温度を測定しながら、焼灼します。食道温度の上昇は、食道の温熱障害を示唆しますので、すぐに焼灼を中止します。
このような予防対策をとることで、現在では、心房食道瘻や胃蠕動運動障害といった重症の合併症はほとんど起きていません。ただし、軽度の食道炎は起きています。多少の食道炎は致し方なく、完全に無くすことはできません。軽度の食道炎もなくそうとすると、アブレーションそのものができなくなります。これは必要悪だと考えています。たとえ、食道炎が発症したとしても、胃酸分泌を抑える薬で、多くは1周間以内に改善します。
全身麻酔 痛くないアブレーションを実施するために
アブレーション治療は施設によりやり方は様々です。例えば、麻酔。局所麻酔のみで行っている施設もあれば、全身麻酔まで行っている施設もあります。医師により、考え方は様々です。局所麻酔のメリットは「術中に患者さんの意識状態の変化や痛みをいち早くとらえ、合併症予防に役立てる」ということです。
しかし、心臓を焼灼すると、焼く場所によっては激しい痛みを自覚します。「アブレーション治療は痛い」私達が心房細動アブレーションを始めた頃に、良く患者さんから言われた苦情です。手術が終わって、最後に患者さんを覆っている手術カバーをはがすと、患者さんが全身汗でびっしょりということもありました。「寝ている間に手術は終わって欲しい」ほとんどの患者さんに言われます。
私は、アブレーション治療は全身麻酔で行ったほうが良いと思っています。その理由は「患者さんに痛みがなく、手術を楽に受けられる」、人工呼吸器により呼吸が安定し、「心臓の上下運動が少なく、カテーテルの固定が容易で、治療効果が高まり、合併症予防にもつながる」、「患者さんに「痛い、痛い」と言われず、術者のストレスが無い」、などです。
なお、静脈麻酔を注射するためには、それを体に入れるために点滴ルートが必要です。その点滴をする際には、どうしても体に針を刺さねばなりません。当たり前ですが、その際、痛みを自覚します。しかし、最近ではその痛みさえもとるようなものもあるのです。キシロカインテープ(商品名 ペンレス)というもので、針を刺す部位に30分間貼っておくと、針を刺しても痛みを自覚しません。
患者さんが喜んでくれるものを考えることは、医療に携わる者としては、とても重要なことです。「アブレーションを全身麻酔」で、「針を刺す時に痛みを感じないように」以前は考えられなかったようなことが現実のものとなっています。
全員への経食道心エコーは不要
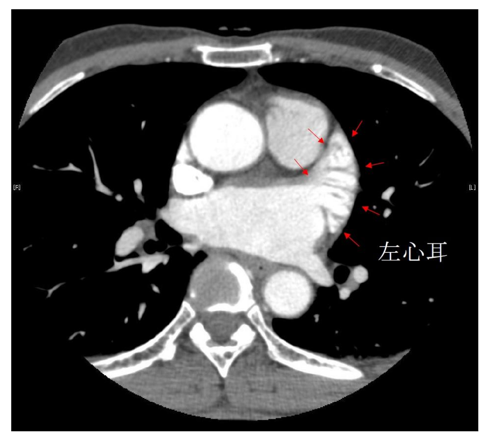
「あの検査を手術前にやるなら、アブレーションは受けたくない。」と多くの患者さんが訴える検査があります。それは、経食道心エコー検査です。心房細動患者さんには、左心房の左心耳というところに、血栓がついていることがあります。そのような状態で、アブレーションを実施すると、カテーテルでその血栓を飛ばしてしまい、手術中に脳梗塞を合併する可能性が高い。故に、予めそこに血栓があるかないか確認しておく必要があります。
左心耳といのは、心臓との間に何の障害物もない食道から観察すると、きれいに描出できます。しかし、その経食道心エコーは、エコーの先端にカメラがついていないために、食道に挿入する際に、患者さんの「嚥下運動」の協力が必要です。つまり、人差し指の太さほどの管を飲み込んでもらわなければならないのです。これが苦痛なのです。数%の患者さんはどうしても飲み込めなくて、検査自体がキャンセルになることもあります。
そこで「奥の手」があるのです。それは”胸部造影CT”(下図)です。造影剤を注射した後に、タイミングを見計らって胸部のCTを撮影します。造影剤がしっかりと左心耳に流入していれば、血栓はないと診断できます。反対に、左心耳に造影剤が流入せずに、欠損像があれば、血栓がついているか、もしくは左心耳への血液流入速度が遅いことが考えられます。経食道心エコー検査は、そのような患者さんに限定して実施すれば良いのです。実際に、そのような所見が得られるのは、全体の約1割です。その1割の4人に1人は、経食道心エコー検査で血栓が見つかります。
造影CTを実施しなければならないので、コスト、造影剤アレルギー、放射線被ばくの問題が生じます。しかし、そのぶん経食道心エコー検査の件数が全体として減少し、患者さんの嚥下の負担はなくなり、また造影CTで得られた画像はそのまま、アブレーションに利用できるというメリットが生まれます。それらすべてを考慮すると、有望な検査の一つと思われます。
尿道バルーンは不要
女性には余り関係のない話しです。男性は尿道が長いので、そこに管(バルーン)を挿入すると、たいていの方は痛みや強い違和感を自覚します。手術室に入ってくる時に、バルーンが入っていると、尿道の痛みのせいか、腰を後ろに引いて、前かがみになっています。
人は誰でもそうですが、昔から一般的に普通にやられているものは、正しいと思いがちです。アブレーション手術の際の、尿道バルーンもそうです。大昔から、検査も含めて、カテーテル室に入る患者さんには皆さん尿道バルーンを入れていたのです。
尿道バルーンを入れる理由は、点滴量の管理です。どの程度の点滴が体に入り、尿として出たのか。点滴の量が多く、尿量が少ないと、肺うっ血といって、余分な水が肺にたまり、呼吸困難を起こす可能性があります。
しかし、アブレーションはたかだか2〜3時間で終了します。点滴の量も多くありません。それほど厳重な点滴量の管理が必要か。100人の患者さんに、尿道バルーンを入れずにアブレーションを実施してみました。尿量が分からず、点滴の量が調整できず、肺うっ血になった人は皆無でした。
術後に止血が完了するまで安静で仰向けに寝ていなければなりません。その際は、尿意を催しても、排尿が困難な方がいます。そういう時だけ、極めて細い管を膀胱まで挿入して、排尿を介助します。その管は尿道よりも細いので、痛みは感じません。
現段階では、ほとんどの施設がアブレーション時には尿道バルーンを入れていると思いますが、近いうちに入れなくても、問題ないということが浸透して行くのではないかと願っています。
術後注意事項
アブレーションを実施すると、10%程度の患者さんですが、術後1ヶ月以内に心房細動が再発することがあります。その時期は、焼灼により心房がやけどをしている状態です。皮膚がやけどをすると、その部位が発赤し、水ぶくれができます。それと同じことが心房でも起きています。焼灼した部位は、腫れ上がり、熱を発します。そこから炎症性の物質を放出するので、アブレーション直後は37度台の微熱が出ます。また、その炎症性物質の刺激により、術後1ヶ月以内に心房細動が起きることがあるのです。手術前とは異なるメカニズムで心房細動が起きます。しかし、このやけどはしばらくすると、癒えてきますので、術後1ヶ月以降、これによる心房細動は自然に治まってきます。
【執筆】桑原大志 医師・医学博士
東京ハートリズムクリニック院長
日本不整脈心電学会認定不整脈専門医